Le piastrine possono promuovere la transizione epiteliale-mesenchimale (EMT) nelle cellule tumorali
Un nuovo meccanismo descritto nel lavoro di Paola Patrignani recentemente accettato per la pubblicazione sul Journal of Lipid Research (IF 5,922), rivista leader sulla scienza dei lipidi nella salute e nella malattia.
Il titolo del lavoro di ricerca è "Le piastrine inducono la generazione di 12-HETE libera e esterificata nelle cellule tumorali del colon fornendo 12-lipossigenasi". I primi autori sono Annalisa Contursi, Simone Schiavone e Melania Dovizio. Molto apprezzato il contributo di altri coautori nazionali e internazionali. In particolare, Valerie B. O'Donnell e i suoi collaboratori dell'Università di Cardiff (UK) e Angel Lanas dell'Università di Saragozza. Si segnala inoltre la collaborazione con altri ricercatori CAST: Stefania Tacconelli, Rosa Fullone, Paola Lanuti, Marco Marchisio, Mirco Zucchelli e Patrizia Ballerini.
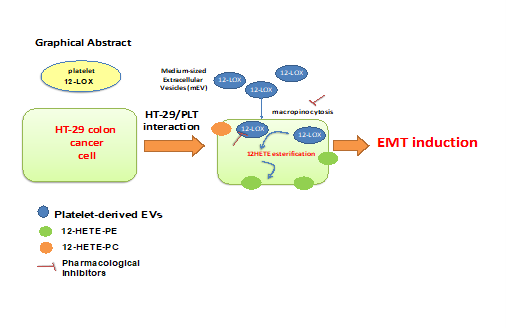
I ricercatori hanno identificato un nuovo meccanismo attraverso il quale le piastrine possono promuovere le metastasi del cancro. I dati sono affascinanti: le piastrine possono promuovere la transizione epiteliale-mesenchimale (EMT) nelle cellule tumorali, un fenomeno già noto per conferire al tumore un alto grado di malignità, attraverso il trasferimento dell’arachidonato 12-lipossigenasi (12-LOX), contenuta nelle vescicole extracellulari di medie dimensioni derivate dalle piastrine (mEVs). Quindi le cellule tumorali diventano in grado di generare acido- 12-idrossieicosatetraenoico (12-HETE), considerato un modulatore chiave delle metastasi tumorali. Lo studio ha dimostrato che il 12-HETE è principalmente esterificato in fosfolipidi plasmalogeni. La modifica dei fosfolipidi delle cellule tumorali da parte di 12-HETE può avere un impatto funzionale sulla biologia delle cellule tumorali e rappresentare un nuovo bersaglio per lo sviluppo di agenti antitumorali. Gli inibitori selettivi di 12-LOX, che sono in fase di sviluppo clinico, come ML-355, o gli inibitori della macropinocitosi, che impediscono l'internalizzazione dei mEVs, sono dunque dei potenziali antitumorali.