Patologia Molecolare
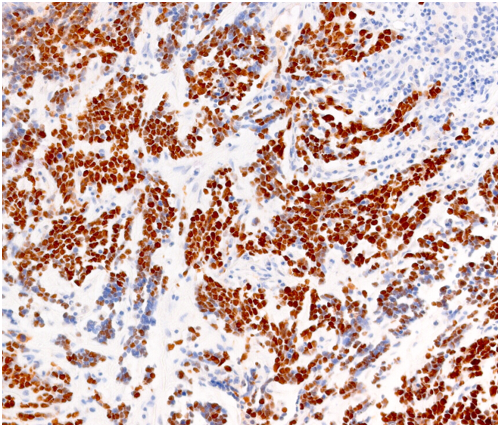
STAINS: Hematoxylin & Eosin, Special stains, Immunohistochemical stains
INFO Service
Il Laboratorio fornisce ai ricercatori universitari le risorse per la processazione e la valutazione di campioni di tessuto derivati da modelli patologici sperimentali e campioni clinici. Particolare enfasi viene data alla fenotipizzazione campioni tissutali patologici prelevati da cute, polmone, fegato, pancreas, milza, reni, vescica, mammella, apparato riproduttivo maschile e femminile, ghiandola tiroidea, timo ed encefalo. Per espletare al meglio questa sua missione, il laboratorio ha messo a punto una serie di procedure di istopatologia e fornisce assistenza e programmi di formazione per le seguenti attività:
- Processazione tissutale e allestimento del campione
- Fissazione del tessuto e inclusione in blocchi di paraffina e OCT.
- Preparazione di sezioni da tessuto incluso in paraffina e criosezioni
- Costruzione di microarray tissutali (TMA)
- Ematossilina ed eosina/colorazioni speciali.
- Immunoistochimica (IHC)
- Immunofluorescenza (IF).
L’IHC è un ulteriore servizio disponibile: la tecnica consente l'identificazione di target specifici (antigeni) all'interno di cellule e tessuti. Ciò comporta l'uso di anticorpi diretti verso gli obiettivi specifici di interesse. La reazione risultante antigene/anticorpo viene quindi visualizzata etichettandola mediante un “label” permanente (cromogeno o fluoroforo). La presenza dell'antigene di interesse può quindi essere osservata al microscopio. Attraverso l’uso di più microscopi ottici, il personale può assistere i ricercatori nell’acquisizione di immagini dai vetrini in diversi formati (tiff/jpeg/png/bmp) adatti per qualsiasi tipo di pubblicazione specializzata.
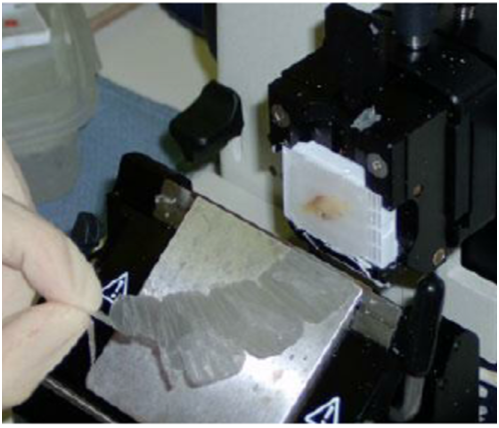
PROCESSING & SECTIONING: Sectioning of paraffin and OCT embedded tissue blocks
DATA ANALYSIS: Digital microscope acquisitions and data documentation by certified Pathologists
INFORMAZIONI PER L’ACCESSO AL SERVIZIO
Lo staff del Laboratorio di Istopatologia è pronto a fornire ai ricercatori una formazione di base e avanzata sul corretto utilizzo delle tecniche istopatologiche e delle procedure di colorazione immunoistochimica. A tal fine, prima di poter utilizzare qualsiasi strumento di laboratorio specifico o procedura di colorazione, i ricercatori sono tenuti a partecipare a seminari di formazione teorico-pratica organizzati e condotti dal personale del laboratorio di Istopatologia.
Processatore di Tessuti Leica ASP300
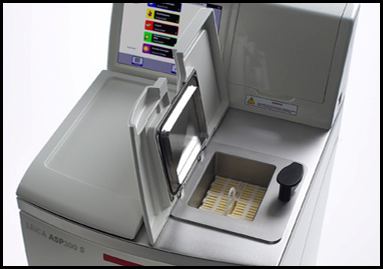
Leica ASP300 è un processore di tessuti progettato per le infiltrazione con paraffina di campioni istologici e per l'istopatologia di routine e di ricerca fino a 300 biocassette. È fornito di un Reagent Management System (RMS) che consente di personalizzare l'uso di reagenti per giorni, con una funzione di avvio rapido per i programmi di uso comune. Il processore tissutale consente quattro tipi di agitazione delicata e il controllo della temperatura, dotato di sensori di livello ottici, senza manutenzione, per garantire una qualità del campione ottimale e costante. I gruppi di dati di ogni processo vengono registrati in un file e possono essere stampati o scaricati su un disco. Il processore tissutale è in grado di rilevare interruzioni di corrente o errori operativi, come bottiglie di reagente mancanti, corregge automaticamente il problema oppure visualizza la soluzione consigliata per salvaguardare i campioni. Anno di acquisizione: 2003READ MORE
Leica EG-1160 Embedding Center

Il Leica EG 1160 Tissue Embedding Center è dotato di un serbatoio di paraffina da tre litri e ha una superficie di lavoro riscaldata resistente ai graffi con un sistema di scarico della paraffina. Ha due vassoi per i rifiuti di paraffina, rimovibili e riscaldati, una cassetta rimovibile e intercambiabile, uno scalda stampo una grande piastra peltier di raffreddamento. Le temperature sono regolabili sui moduli di riscaldamento tra 45 °C e 70 °C, con un timer di on/off programmabile. La capacità è di circa 100 cassette e/o stampi. Anno di acquisizione: 2003READ MORE
Microtomo Leica RM2125 RT

Il Microtomo Rotativo Leica RM2125 RT è stato progettato per garantire un sezionamento manuale senza sforzi, grazie a un volantino controbilanciato ben funzionante. La testa dell'oggetto con orientamento X/Y di -/-8° è dotata di un sistema di sostituzione rapida del morsetto portacampione, che garantisce un flusso di lavoro migliore. L'impostazione dello spessore della sezione varia da 0,5 a 60 μm. Anno di acquisizione: 2003READ MORE
Criostato Leica CM1850

Leica CM1850 è un criostato versatile con un sistema di raffreddamento ottimizzato, di congelamento rapido dei campioni e di orientamento uniforme del campione per un sezionamento di alta qualità sia per i campioni istologici di routine sia per la ricerca. L'impostazione dello spessore della sezione varia da 1 a 60 μm (con incrementi di 1 μm da 1 a 10 μm; incrementi di 2 μm da 10 a 20 μm; incrementi di 5 μm da 20 a 60 μm). La dimensione massima del campione è di 55 x 55 mm. L'impostazione della temperatura varia da 0°C a -35°C. Anno di acquisizione: 2003READ MORE
Dako Autostainer E-172566

Il sistema Dako Autostainer E-172566 è un sistema aperto automatizzato di elaborazione dei vetrini, compatibile con tutti i reagenti utilizzati per la colorazione di sezioni di tessuto incorporate in paraffina e congelate, citospin, strisci cellulari e aspirati ad ago. Può gestire 64 diversi reagenti (flaconcino da 15 mL/reagente). Eroga volumi di reagenti da 100 a 600 μL. Questo sistema è progettato per automatizzare i metodi di colorazione manuale abitualmente utilizzati in immunoistochimica e citochimica, consentendo il trasferimento dei protocolli dal banco di laboratorio all'Autostainer, senza necessariamente richiedere una modifica dei reagenti standard o delle condizioni sperimentali. È dotato di 4 griglie, ognuna delle quali può contenere 12 vetrini in posizione orizzontale. Le dimensioni del vetrino supportate sono 25mm x 75mm x 1mm. Anno di acquisizione: 2003READ MORE
Arrayer Tissutale Manuale MTA-1

L'arrayer manuale consente la costruzione di microarray tissutali (TMA). È uno strumento di arraying ad alta precisione azionato manualmente e in grado di creare matrici fino a 500 campioni per blocco destinatario. E’ dotato di due paia di bisturi biopsia-punch, di dimensioni di 0,6 mm, 1,0 mm, 1,5 mm e 2,0 mm di diametro. La velocità (core/ora) nel montaggio manuale del blocco TMA è di 30-70. L'altezza massima del blocco donatore consentita è di 3 cm. Anno di acquisizione: 2005READ MORE
Nota: il Laboratorio di Istopatologia è dotato dei seguenti ulteriori strumenti: microtomo a slitta, bagnetto per istologia, coloratore Leica ST5010 AutostainerXL, stufa a convezione, forno a microonde, pentola a pressione; materiali di consumo per istologia: vetrini, paraffina, lame del microtomo, biocassette, reagenti e soluzioni per colorazioni di routine, speciali e IHC, resine di montaggio per microscopia, vetrini adesivi e per sezioni congelate.
Bomba M, Granzotto A, Castelli V, Onofrj M, Lattanzio R, Cimini A, Sensi SL. Exenatide reverts the high-fat-diet-induced impairment of BDNF signaling and inflammatory response in an animal model of Alzheimer's disease. Journal of Alzheimer's Disease. 2019:1-18. doi: 10.3233/JAD-190237
Giansanti F, Capone E, Ponziani S, Piccolo E, Gentile R, Lamolinara A, Di Campli A, Sallese M, Iacobelli V, Cimini A, De Laurenzi V, Lattanzio R, Piantelli M, Ippoliti R, Sala G, Iacobelli S. Secreted Gal-3BP is a novel promising target for non-internalizing Antibody-Drug Conjugates. Journal of Controlled Release. 2019; 294:176-184. doi: 10.1016/j.jconrel.2018.12.018
Lattanzio R, Iezzi M, Sala G, Tinari N, Falasca M, Alberti S, Buglioni S, Mottolese M, Perracchio L, Natali PG, Piantelli M. PLC-gamma-1 phosphorylation status is prognostic of metastatic risk in patients with early-stage Luminal-A and -B breast cancer subtypes. BMC Cancer. 2019;19. doi:10.1186/s12885-019-5949-x
Guerra E, Trerotola M, Tripaldi R, Aloisi AL, Simeone P, Sacchetti A, Relli V, D'amore A, La Sorda R, Lattanzio R, Piantelli M, Alberti S. Trop-2 induces tumor growth through Akt and determines sensitivity to Akt inhibitors. Clinical Cancer Research. 2016;22:4197-4205. doi: 10.1158/1078-0432.CCR-15-1701
De Cola A, Volpe S, Budani MC, Ferracin M, Lattanzio R, Turdo A, D'agostino, D, Capone E, Stassi G, Todaro M, Di Ilio C, Sala G, Piantelli M, Negrini M, Veronese, A, De Laurenzi Vincenzo. Mir-205-5p-Mediated Downregulation Of Erbb/HER Receptors In Breast Cancer Stem Cells Results In Targeted Therapy Resistance. Cell Death & Disease. 2015;6:e1823. doi: 10.1038/cddis.2015.192
Simeone P, Trerotola M, Urbanella A, Lattanzio R, Ciavardelli D, Di Giuseppe F, Eleuterio E, Sulpizio M, Eusebi V, Pession A, Piantelli M, Alberti S. A unique four-hub protein cluster associates to glioblastoma progression. Plos One. 2014;9.ISSN: 1932-6203. doi:10.1371/journal.pone.0103030
Esposito DL, Aru F, Lattanzio R, Morgano A, Abbondanza M, Malekzadeh R, Bishehsari F, Valanzano R, Russo A, Piantelli M, Moschetta A, Lotti LV, Mariani-Costantini R. The insulin receptor substrate 1 (IRS1) in intestinal epithelial differentiation and in colorectal cancer. Plos One. 2012;7:1-14. doi: 10.1371/journal.pone.0036190
 Rossano LattanzioProfessore Associato di |
||


