Gruppo Mariggiò
Interessi di ricerca
L’area di ricerca del gruppo rientra nell’ambito dello studio delle risposte cellulari al micro- e al macro-ambiente, finalizzato ad applicazioni traslazionali nel campo della biomedicina. In particolare, vari modelli cellulari (quali cellule dal fenotipo muscolare scheletrico e cardiaco, neuronale, linfocitorio e linfociti del sangue periferico, cellule staminali dell’adulto) sono utilizzati per indagare le risposte ad agenti chimici (come fattori di crescita, ormoni, farmaci) e fisici (radiazioni elettromagnetiche a bassa frequenza, microgravità, pressione parziale di ossigeno) e alle interazioni tra cellule e materiali biocompatibili.
Il comportamento dei modelli cellulari studiati viene analizzato focalizzando l’attenzione sulla trasduzione del segnale mediata da variazioni dello ione calcio intracellulare, sull’attività elettrica di membrana e sullo stato ossidativo/metabolico, in cui l'attività mitocondriale svolge un ruolo predominante.
Le tecniche utilizzate si basano sulla microscopia convenzionale, a fluorescenza confocale e di patch-clamp, oltre alle indagini biochimiche di base per la verifica delle funzioni cellulari.
Caratterizzazione del ruolo della proteina GAP43 (Growth Associated Protein 43) nelle cellule muscolari
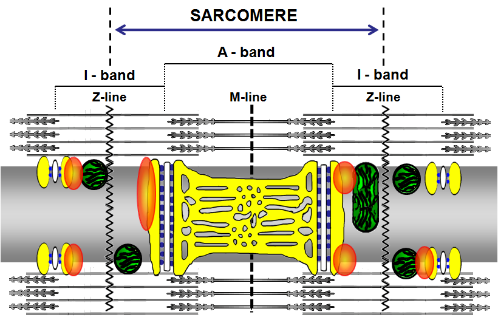
Un modello per la localizzazione della GAP43 nel muscolo scheletrico. Nello schema proposto la fibra muscolare è osservata lungo il suo asse longitudinale. Il reticolo sarcoplasmatico è raffigurato in giallo, mentre i mitocondri su entrambi i lati delle linee Z, sono rappresentati in verde. Le strutture bianche raffigurano i tubuli a T e i piccoli quadrati in blu sono i recettori della ryanodina. Gli ovali arancioni rappresentano la GAP43. Guarnieri et al, 2013, PLoS ONE 8(1): e53267. doi:10.1371/journal.pone.0053267 Negli ultimi anni, un evento casuale, rappresentato dall'uso di anticorpi anti-GAP43, considerato uno specifico marcatore neuronale, in co-colture neuromuscolari, ha attirato la nostra attenzione sulla presenza in cellule muscolari scheletriche della proteina GAP43. È stato così sviluppato uno studio che ha descritto l’espressione di questa proteina nelle cellule muscolari scheletriche del topo e dell'uomo, con diverse localizzazioni in base al fenotipo indifferenziato o maturo. In quest'ultimo, la proteina è disposta regolarmente tra i mitocondri e le unità di rilascio del calcio, suggerendo un ruolo funzionale specifico (Guarnieri et al, PlosOne 2013). La presenza della proteina anche nel muscolo scheletrico di pesci e anfibi avvalora il ruolo strategico che essa svolge nei muscoli (Caprara et al, Eur J Histochem 2014). L'uso di topi transgeniciknockout per GAP43 ha permesso di verificare l'ipotesi secondo la quale, nel muscolo scheletrico, GAP43 interagisca con la calmodulina per modulare indirettamente l'attività dei canali RyR e DHPR. Ciò può influenzare la dinamica dell'omeostasi del Ca2+ e, di conseguenza, tutti i processi a valle, tra cui accoppiamento eccitazione-contrazione, espressione genica e metabolismo cellulare (Caprara et al, Front Physiol. 2016).READ MORE
Analisi dell'omeostasi cellulare a seguito ad esposizione a particolari condizioni ambientali (campi elettromagnetici e gravità)
Campi elettromagnetici a bassa frequenza. Non meno coinvolgenti si sono rivelati gli studi sugli effetti dei campi elettromagnetici a frequenze estremamente basse (ELF-EMFs) su vari modelli animali e cellulari. Un progetto pluriennale, finanziato dal Ministero dell'Ambiente e della Tutela del Territorio, ha permesso una ricerca multidisciplinare che ha affrontato sia problematiche tecnologiche (come lo sviluppo e la standardizzazione di sistemi per la generazione di campi elettromagnetici e strumenti per verificarne l'efficienza, Farina et al, Progr Electromagn Res-B 2010) sia aspetti biologici, quali la verifica degli effetti di ELF-EMFs in vitro (su cellule procariotiche ed eucariotiche) e in vivo (su ratti giovani e anziani e topi transgenici predisposti a tumori mammari). I primi risultati hanno evidenziato che l'esposizione agli ELF-EMFs induce stress ossidativo (Mariggiò, Amicarelli et al, in Biological Effects of Electromagnetic Fields 2006; Falone et al, Int J Biochem Cell Biol 2008; Morabito et al, Free RadicBiol Med 2010; Morabito et al, Cell Physiol Biochem, 2010). Le intensità di campo utilizzate (0,1-1,0 mT) hanno innescato meccanismi di adattamento sia a livello cellulare (attraverso meccanismi di compensazione che coinvolgono i segnali del Ca2+ intracellulare e sistemi redox cellulari) sia in organismi complessi (Mariggiò, Amicarelli et al, Mariggiò, Morabito et al, Iezzi et al, in BiologicalEffects of Electromagnetic Fields 2006; Falone et al, Int J Biochem Cell Biol 2008; Morabito et al, Free RadicBiolMed 2010; Morabito et al, Cell Physiol Biochem, 2010; Morabito et al, Biomed ResInt. 2017). Le cellule procariotiche sembrano essere più suscettibili alle esposizioni elettromagnetiche in termini di cambiamenti morfologici e di profili di espressione genica (Cellini et al, Bioelectromagnetics 2008). La microgravità. Nell'ambito di un progetto riguardante lo studio delle relazioni intercellulari all'interno del sistema nervoso, è stata impiegata una linea astrocitaria umana (GL15) (Castellano et al, Arch Pharm 2000; Mariggiò et al, BMC Physiol 2001) per sviluppare un modello in vitro di co-coltura astrocita-neurone. Questa linea cellulare, insieme alla linea di neuroblastoma umano SH-SY5Y, è stata utilizzata per lo sviluppo di colture tridimensionali omo- ed eterotipiche impiegate per verificare gli effetti della microgravità sulle interazioni cellula-cellula. A tal fine, è stato utilizzato un bioreattore con una camera rotante su un asse orizzontale (Rotating Wall Vessel, RCCS ™) per simulare la microgravità e, allo stesso tempo, consentire le interazioni intercellulari. I dati preliminari mostrano che, coltivando le cellule in RCCS, si formano aggregati cellulari stabili omo- ed eterotipici che restano vitali fino a un mese di coltura. La crescita in queste condizioni consente di mantenere le caratteristiche fenotipiche e funzionali delle cellule ma determina cambiamenti significativi nella struttura citoscheletrica (Morabito et al, Bio Med Res Int 2015). Questi risultati sono rilevanti per la messa a punto in vitro di colture tridimensionali e dimostrano che la microgravità è uno stimolo esterno in grado di determinare cambiamenti della forma e, probabilmente, anche dell'attività funzionale (Mariggiò e Fanò-Illic Science Proceedings 2015). Per definire la relazione tra forma e funzione cellulare, è stato sviluppato un approccio sperimentale quantitativo basato su analisi d’immagine per definire la forma cellulare, e utilizzando la Normalized Bending Energy e un modello di cellule tumorali chemioresistenti (Pasqualato et al, Exp.Cell.Res. 2012). Il progetto di ricerca SHAPE, selezionato e finanziato dall'Agenzia Spaziale Italiana, ha permesso di verificare se e come le condizioni di microgravità simulata interferiscano con il metabolismo cellulare e lo stato redox. Il progetto è stato sviluppato utilizzando un simulatore di microgravità, la Random Positioning Machine (RPM) e modelli cellulari normalmente coltivati in adesione e sospensione. Nelle cellule TCam-2, un modello di cellule germinali maschili umane, l'uso di antiossidanti contrasta gli effetti indotti dalla microgravità simulata e, inoltre, queste cellule sono in grado di rispondere con meccanismi adattativi, recuperando la loro normale attività proliferativa (Morabito et al, Sci Reports 2017). La stessa strategia di protezione con antiossidanti contrasta gli effetti della microgravità simulata anche in altri modelli in adesione come gli osteoblasti MC3T3-E1 e i cardiomiociti H9C2 (Morabito et al, Int J Mol Sci 2020; Guarnieri et al, Oxid Med Cell Longev 2021). Nelle cellule Jurkat, che esprimono il fenotipo linfocitario, la microgravità induce un aumento del tasso di proliferazione con concomitante riduzione del Ca2+ intracellulare e dei ROS. Anche queste cellule mostrano meccanismi adattivi (Morabito et al, Int J Mol Sci. 2019).READ MORE
Meccanismi di differenziamento delle cellule staminali multipotenti
Il nostro interesse per lo studio dei meccanismi legati al differenziamento cellulare include cellule derivate da tessuti post-mitotici (Fanò et al, Basic Appl Myol 2004). Grazie al contributo di un progetto nazionale, in collaborazione con l'Università "La Sapienza" di Roma, è stato possibile verificare in vitro il potenziale differenziativo delle cellule satelliti isolate dal muscolo scheletrico e come questo modello conservi la "memoria" del tessuto da cui proviene. Le cellule satelliti derivate da muscoli di topi transgenici che overesprimono l’isoforma muscolare del fattore di crescita insulino-simile di tipo 1 (mIGF-1), mostrano una maggiore sensibilità agli stimoli trofici rispetto alle cellule di topi del ceppo originario, con accelerazione del processo miogenico e aumento della mobilizzazione del Ca2+ intracellulare, aspetti che sembrano rispecchiare l'ipertrofia muscolare osservata negli animali transgenici (Guarnieri et al, PlosOne 2014). Una collaborazione con l'Università di Ancona ha portato alla caratterizzazione funzionale di un modello cellulare rappresentato da cellule staminali mesenchimali derivate da biopsie cutanee umane, utili come modello in vitro per lo studio del differenziamento cellulare (Orciani et al, Skin Pharmacol e Physiol 2010). In parallelo, altri modelli sono stati utilizzati per studiare la neurogenesi: cellule staminali mesenchimali derivate dal liquido amniotico (AFMSC) e cellule staminali derivate dal nucleo polposo dei dischi intervertebrali umani. La crescente attenzione internazionale verso tali modelli riflette la possibilità di utilizzare queste cellule in medicina rigenerativa in alternativa a quelle derivate dal midollo osseo. La prima fase dello studio ha confermato la multipotenza delle AFMSC che, tuttavia, in vitro non sono in grado di completare il loro differenziamento funzionale neuronale (Orciani et al, J BiolRegul Omeost Agents 2011). Le cellule mesenchimali derivate dal nucleo polposo, indotte a differenziare in senso neuronale, hanno mostrato caratteristiche morfologiche tipiche del fenotipo neuronale, ma non hanno sviluppato capacità funzionali (Lazzarini et al, J Mol Neurosci. 2018). Questi risultati hanno incoraggiato la partecipazione a uno studio multidisciplinare (dalla ricerca di base a quella clinica) all'interno del gruppo StemTeCh formato nel 2009 dai ricercatori delle Università "G. d'Annunzio" di Chieti-Pescara e Teramo. Questa sinergia ha anche permesso di richiedere e ottenere finanziamenti. Diversi sono stati gli studi condotti in collaborazione sul modello di cellule mesenchimali derivate da liquido amniotico, tra cui la caratterizzazione approfondita delle cellule, la definizione del ruolo dei recettori sensibili al Ca2+ e della calcitonina nei processi osteogenici e nel differenziamento cardiomiocitario (Di Tomo et al, PlosOne 2013, Morabito et al, Cell Physiol Biochem 2015; Pipino et al, Stem Cells Dev 2015, Di Baldassarre et al, Sci Rep. 2018). All'interno del gruppo StemTeCh, il differenziamento osteogenico è stato studiato anche nelle cellule stromali mesenchimali del tessuto adiposo sottocutaneo umano, investigando il ruolo dei recettori purinergici. I risultati di questo studio hanno evidenziato un'attività pro-osteogenica indotta da ATP e adenosina endogene. Al contrario,l'osteogenesi risulta alterata in presenza di alti livelli di ATP,che si verificano ad esempio nel caso di lesioni tissutali (Carluccio et al, Stem Cell Rev. 2019).READ MORE
Ruolo dei linfociti come biosensori della risposta funzionale integrata
Per sviluppare un modello cellulare che potesse rappresentare un "biosensore" delle risposte adattative di tutto l'organismo, ci siamo concentrati sui linfociti, la cui attività, classicamente correlata alla risposta immunitaria, è modulata da situazioni fisiologiche e fisiopatologiche. In questo contesto nei linfociti ottenuti da pazienti con diabete di tipo 2, sono state rivelate alterazioni dei sistemi di segnalazione intracellulare dipendenti dal Ca2+ e dallo stato ossidoriduttivo (Belia et al, Free Radic Res 2009). Gli stessi sistemi di segnalazione intracellulare sono modificati, con diversa entità e tempistica, nei linfociti provenienti da soggetti esposti all'ipossia ipobarica ad alta quota o da subacquei in apnea dopo differenti condizioni di preossigenazione (Mariggiò et al, High Alt Med Biol 2010; Morabito et al, Acta Physiol 2011; Morabito et al, Scand J Med Sci Sports 2016).READ MORE
Determinazione delle caratteristiche funzionali mediante approcci su singola cellula
Sulla base delle nostre competenze e dei nostri approcci sperimentali, sono state intraprese numerose collaborazioni, alcune delle quali ancora in corso. Queste includono: studi sui meccanismi coinvolti nella motilità cellulare (2000-2002 in collaborazione con il Dr. M. Falasca, UCL, London UK; Razzini et al, J Biol Chem. 2000; Piccolo et al, Oncogene 2002); la risposta in vitro di vari tipi di cellule al manganese, che, a seconda della concentrazione e del tempo di permanenza nel mezzo di coltura, può comportarsi come nutriente o come agente tossico, innescando meccanismi alla base di disturbi epatici, renali e nervosi (2000-presente in collaborazione con la Prof.ssa G. Mazzoleni, Università di Brescia, Brescia Italia; Rovetta et al, Toxicol in Vitro 2007). Collaborazioni scientifiche sono state stabilite anche grazie allo sviluppo di metodi su singola cellula sia in fluorescenza sia in elettrofisiologia, per lo studio della morfologia e delle caratteristiche funzionali cellulari, attraverso la misura delle correnti ioniche, l'analisi delle variazioni di Ca2+ intracellulare e/o la produzione di molecole reattive (NO e ROS). Questi studi hanno permesso di arricchire la nostra conoscenza dei modelli cellulari utilizzati e di sottolineare come le cellule, in diverse condizioni (disturbi metabolici, stimolazione con estratti naturali, agenti farmacologici o fattori trofici) possano produrre molecole che fungano da secondi messaggeri o fattori tossici (collaborazioni pluriennali ancora in corso con diversi gruppi dell'Università G.d'Annunzio di Chieti-Pescara e dell'Università La Sapienza di Roma (Di Pietro et al, J Cell Biochem 2006; Bonomini et al, PloSOne 2012; Di Pietro et al, Aterosclerosi 2013; Delli Pizzi et al, PlosOne 2013; Frazzini et al, Cell Death Dis 2016; Dinicola et al, Br J Nutr 2013; Trubiani et al, Cell Signal 2016, Totani et al, Biochim Biophys Acta 2017, Del Porto et al, PlosOne 2011; Cifani et al, J Cystic Fibrosis 2011; De Rocco et al, Int J Mol Sci 2018). La ricerca di nuovi approcci sperimentali per la caratterizzazione funzionale delle cellule e la collaborazione con la Dott.ssa E. Jonas (Department of Internal Medicine, Yale University, USA), hanno permesso di partecipare ad un progetto volto a definire il ruolo del Bcl-XL nella regolazione del metabolismo cellulare neuronale (Alavian et al, Nat Cell Biol 2011; Alavian et al, Brain Res 2012). Abbiamo anche partecipato attivamente a uno studio volto a standardizzare i protocolli semi-quantitativi di fluorescenza su preparati ossei. I dati raccolti finora hanno rivelato che l'autofluorescenza dei preparati ossei istologici da resti umani provenienti da diversi siti archeologici è legata all'età della sepoltura (2010-2018, collaborazione con il Prof. L. Capasso, Università G.d'Annunzio, Chieti; Capasso et al, Forensic Sci Int 2017). L'utilizzo di tecniche di videoimaging a fluorescenza, integrate da approcci sperimentali funzionali, ha permesso anche di studiare le interazioni dei nostri modelli cellulari con materiali biocompatibili allo scopo di sviluppare applicazioni nel campo della biomedicina (collaborazioni con diversi gruppi dell'Università G.d'Annunzio di Chieti-Pescara, Sinjiari et al, J Biol Regul Omeost Agents 2012; Lanuti et al, Biores Open Access 2015; Cataldi et al, J Mater Sci Mater Med 2016).READ MORE



